Am 27. Januar 2022 veröffentlichte die NMPA (National Medical Products Administration) den Jahresbericht 2021 zur Registrierung von Medizinprodukten.
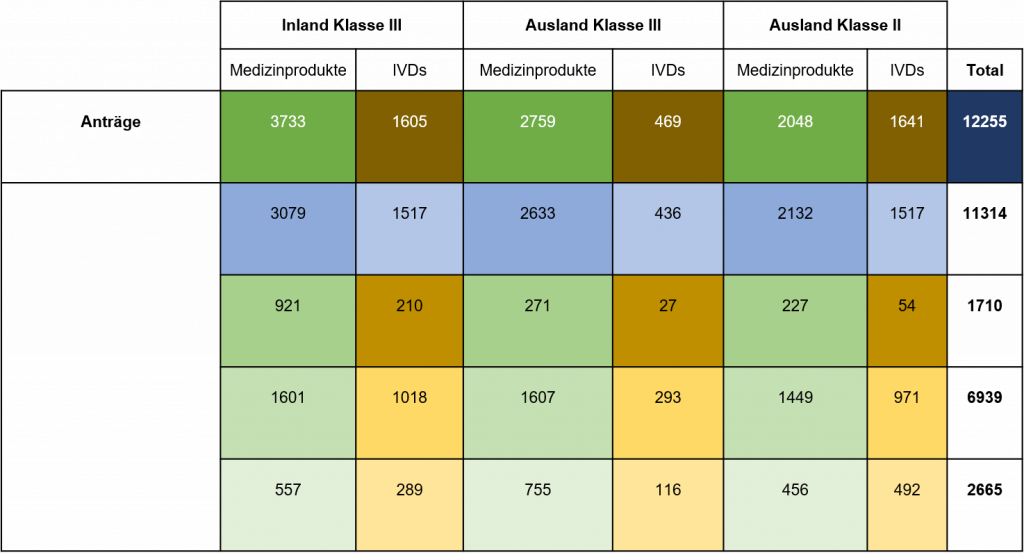
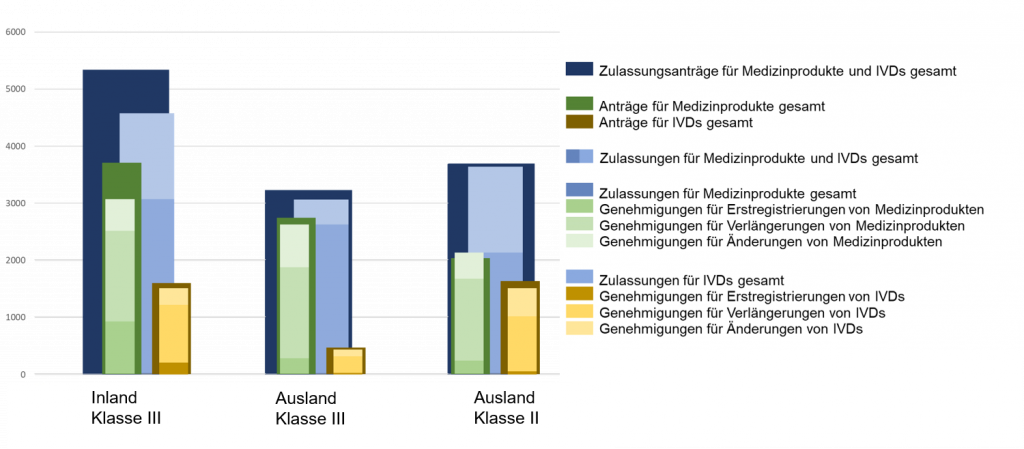
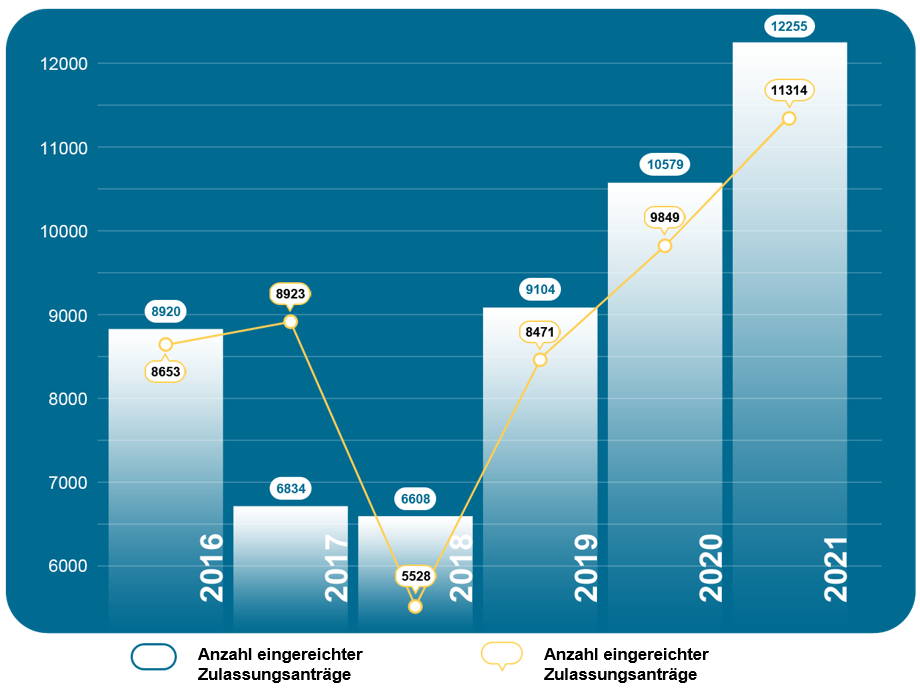
Im Jahr 2021 gingen bei der NMPA insgesamt 12.255 Anträge für die Erstregistrierung, die Verlängerung der Registrierung und die Änderung von Zulassungsunterlagen für Medizinprodukte der Klasse III (Inland und Ausland) und der Klasse II (Ausland) ein, was einem Anstieg von 15,8 % im Vergleich zu 2020 entspricht. Von den 12.255 Anträgen genehmigte die NMPA insgesamt 11.314 Anträge, was einem Anstieg von 14,9 % gegenüber 2020 entspricht. Die NMPA bearbeitete insgesamt 1 854 Anträge für importierte Medizinprodukte der Klasse I, was einem Anstieg von 0,5 % im Vergleich zu 2020 entspricht.
Tabelle 1. NMPA – Anzahl der Anträge und Zulassungen für Medizinprodukte und IVDs
Grafik 1. NMPA – Anzahl der Anträge und Zulassungen für Medizinprodukte und IVDs
Grafik 2. Prozentuale Verteilung der drei Arten von NMPA-Genehmigungen

Grafik 3. Prozentuale Verteilung der Zulassungen für Medizinprodukte und IVDs

Grafik 4. NMPA – Anzahl der genehmigten Registrierungen und Anträge von Januar 2016 bis Dezember 2021
Grafik 5. NMPA – Anzahl der genehmigten Neuzulassungen von Januar 2021 bis Dezember 2021
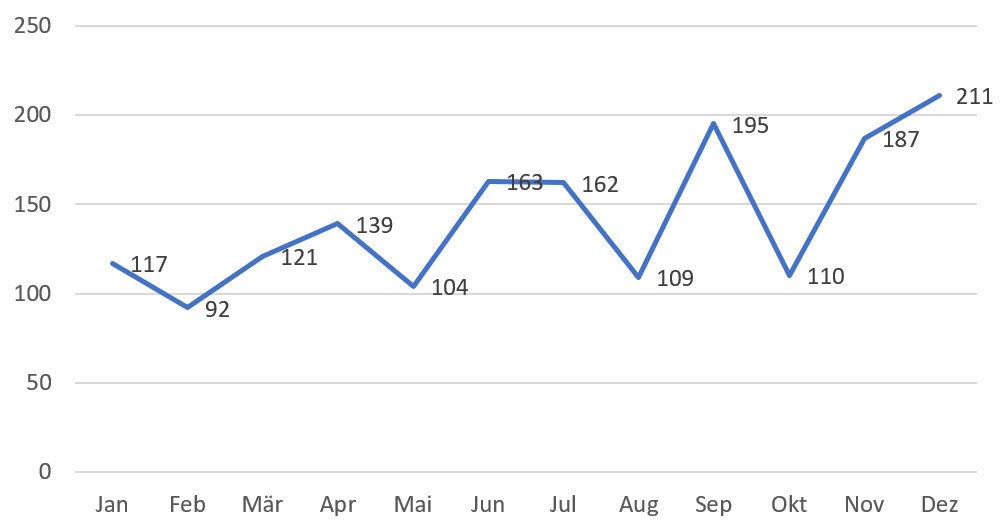
Im Jahr 2021 genehmigte die NMPA insgesamt 1.710 neue Erstregistrierungen.
Die Provinzbehörden für Medizinprodukte (MPAs) genehmigten insgesamt 31.509 Anträge für inländische Medizinprodukte der Klasse II, was einem Anstieg von 6,3 % gegenüber 2020 entspricht.
Die städtischen Behörden für Medizinprodukte (MPAs) bearbeiteten insgesamt 26.773 Anträge für inländische Medizinprodukte der Klasse I, was einem Rückgang von 22,7 % gegenüber 2020 entspricht. Die fünf wichtigsten Produktgruppen der Klassen II und III ausländischen Ursprungs, die im Jahr 2021 registriert wurden, sind:
- Medizinische Bildgebungsgeräte
- Passive Implantate
- Zahnärztliche Instrumente
- Neurologische und kardiovaskuläre chirurgische Instrumente
- Ophthalmologische Produkte
The United States of America, Germany, Japan, Korea and Switzerland continue to have the highest number of initial Die USA, Deutschland, Japan, Korea und die Schweiz verzeichnen wie im letzten Jahr die meisten Erstregistrierungen für Medizinprodukte aus dem Ausland, die 72 % der Gesamtzahl der Erstregistrierungen für Medizinprodukte ausmachen.
Liste der 10 führenden Länder, die Medizinprodukte nach China exportieren
- USA
- Deutschland
- Japan
- Südkorea
- Schweiz
- Italien
- Frankreich
- Vereinigtes Königreich
- Schweden
- Israel
Fast-Track-Zulassung für Medizinprodukte
Die NMPA erhielt 249 Anträge auf Sonderprüfung und Zulassung innovativer Medizinprodukte und 41 Anträge auf vorrangige Prüfung. Insgesamt 35 inländische Medizinprodukte haben die Sondergenehmigung erhalten, um im Jahr 2021 als innovative Medizinprodukte auf den Markt zu kommen.
Von 2014 bis 2021 hat das NMPA insgesamt 127 inländische innovative Medizinprodukte (104 lokale Hersteller) und 7 ausländische innovative Medizinprodukte (fünf globale Hersteller) zugelassen.
Weitere Informationen zu diesem Thema erhalten Sie bei:
Cisema GmbH
Tel.: +49 (0)89 4161 7389-00
info@cisema.de
www.cisema.de

 English
English  Italiano
Italiano  Français
Français  日本語
日本語  한국어
한국어