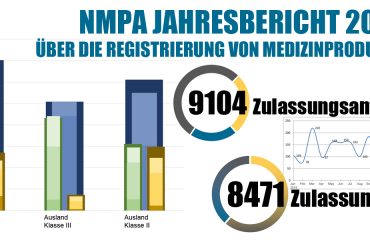
Am 10. März 2020 veröffentlichte die NMPA (Nr.18-2020) die wesentlichen Grundsätze der Sicherheit und Wirksamkeit von Medizinprodukten.
Die Prinzipien beschreiben die grundlegenden Anforderungen an die Konstruktion und Herstellung, die der Antragsteller / der gesetzliche Vertreter der NMPA erfüllen muss, um sicherzustellen, dass das Medizinprodukt während seines gesamten Produktlebenszyklus unter der Kontrolle eines Qualitätsmanagementsystems sicher funktioniert und die beabsichtigte Leistung erbringt.
Die grundlegenden Design- und Herstellungsanforderungen gelten für Medizinprodukte unter verschiedenen Aspekten, wie unten aufgeführt:
– Chemische, physikalische und biologische Eigenschaften
– Sterilisation und mikrobielle Verunreinigung
– Berücksichtigung von Umwelt und Nutzungsbedingungen
– Schutz gegen elektrische, mechanische und thermische Risiken
– Aktive Medizinprodukte und IVD und mit ihnen verbundene Medizinprodukte
– Medizinprodukte, die Software enthalten oder Software als Medizinprodukt darstellen
– Medizinprodukte mit einer Diagnose- oder Messfunktion
– Gebrauchsanweisung (Gebra/IFU) und Produktkennzeichnung
– Schutz vor Strahlung und anderen Risiken
– Medizinprodukte mit pharmazeutischen Inhaltsstoffen (Kombinationsprodukte)
– Besondere Anforderungen für Implantate
Wenn diese Informationen für Sie relevant sind, können Sie sich bei weiteren Fragen gerne an uns wenden.

 English
English  Italiano
Italiano  Français
Français  日本語
日本語  한국어
한국어