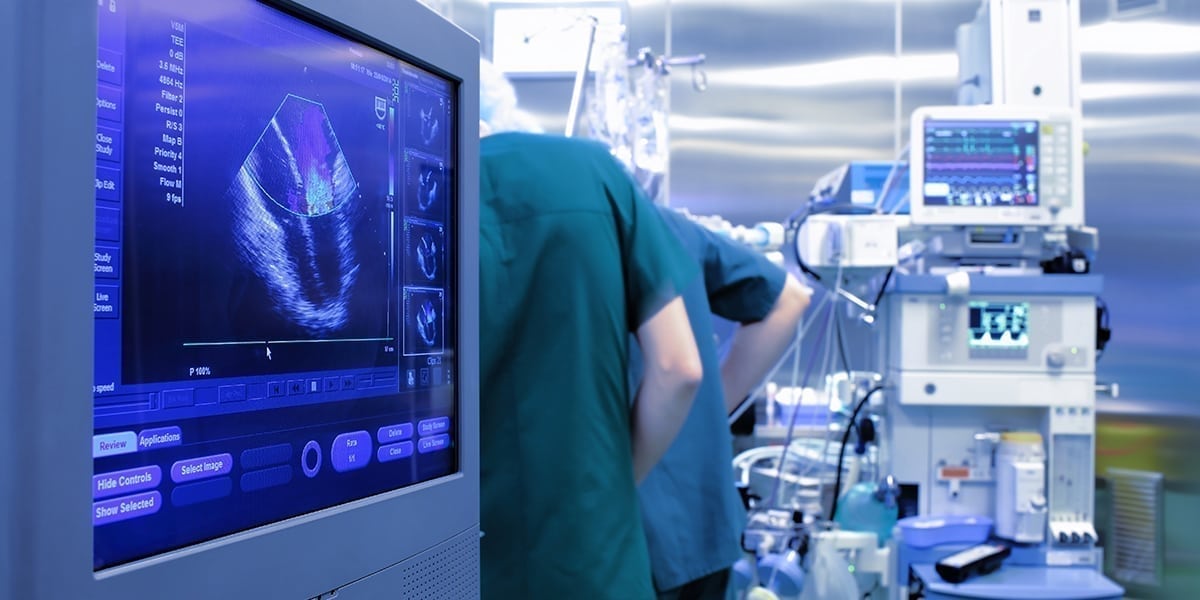
Akzeptanz von ausländischen klinischen Studien soll verbessert werden.
Am 08.10.2017 veröffentlichte das CPC (Central Committee und der State Council) die “Reform of the Examination and Approval System and Encouraging the Innovation of Pharmaceutical and Medical Devices (Draft for Comment)”. Demnach beabsichtigt die NMPA, Daten aus ausländischen klinischen Studien anzuerkennen, wenn diese den chinesischen Anforderungen entsprechen.
Die NMPA kommentierte zudem die folgenden Aspekte zur Verwaltung klinischer Studien:
- Beschleunigung der Überprüfung und Genehmigung des Markteintritts
- Förderung von Arzneimittel-Innovationen und Generika-Entwicklung
- Stärkung des Lifecycle Managements von Pharma und Medical Devices
- Verbesserung der technischen Unterstützung
- Stärkung der Organisation und Umsetzung

 English
English  Italiano
Italiano  Français
Français  日本語
日本語  한국어
한국어