Am 5.Februar 2021 veröffentlichte die NMPA (National Medical Products Administration) ihren Jahresbericht 2020 über die Registrierung von Medizinprodukten
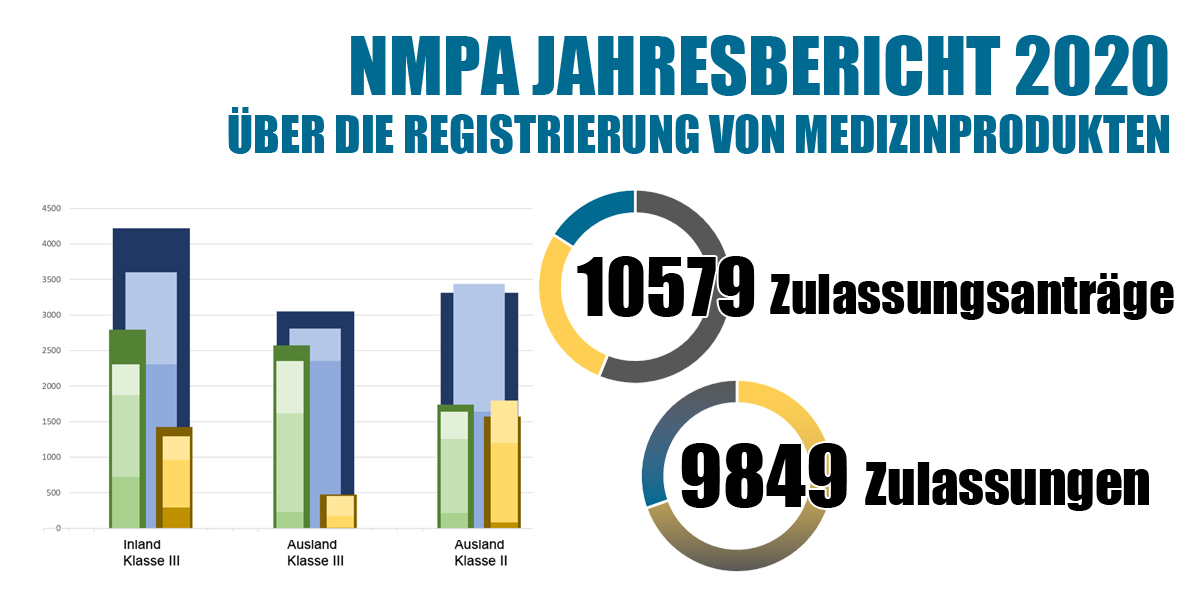
Im Jahr 2020 gingen bei der NMPA insgesamt 10.579 Anträge für die Erstzulassung, Zulassungsverlängerungen und Änderungen in der Zulassung von Medizinprodukten der Klasse III (In- und Ausland) und der Klasse II (Ausland) ein, was einem Anstieg von 15,6% gegenüber 2019 entspricht. Von den 10.579 Anträgen genehmigte das NMPA insgesamt 9.849 Anträge, was einem Anstieg von 16,3% gegenüber 2019 entspricht. Außerdem bearbeitete das NMPA insgesamt 1.844 Anträge für importierte Medizinprodukte der Klasse I, was einer Zunahme von 33,3% gegenüber 2019 entspricht.
Tabelle 1: Anzahl der Anträge und Zulassungen für Medizinprodukte und IVDs bei der NMPA
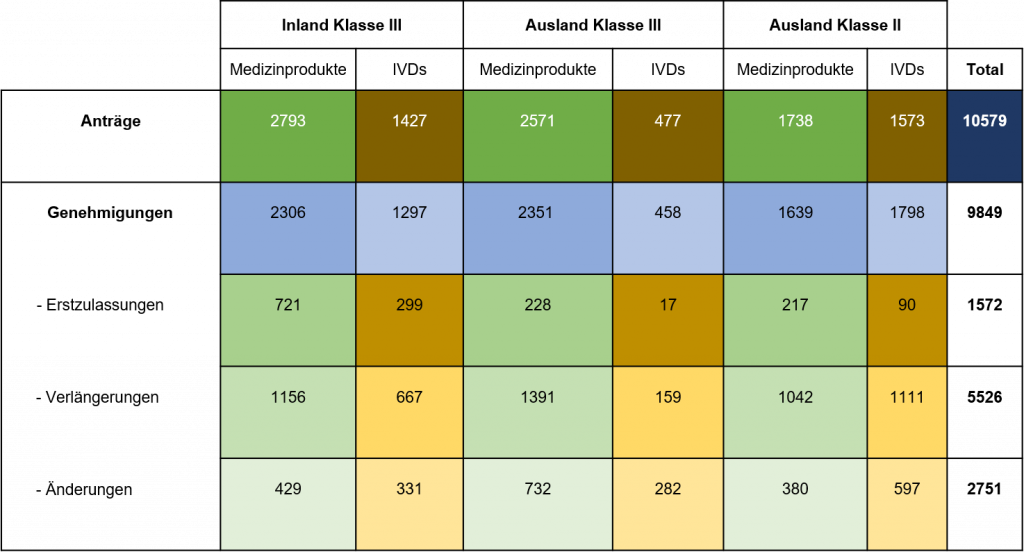
Grafik 1: Anzahl der Anträge und Zulassungen für Medizinprodukte und IVDs bei der NMPA
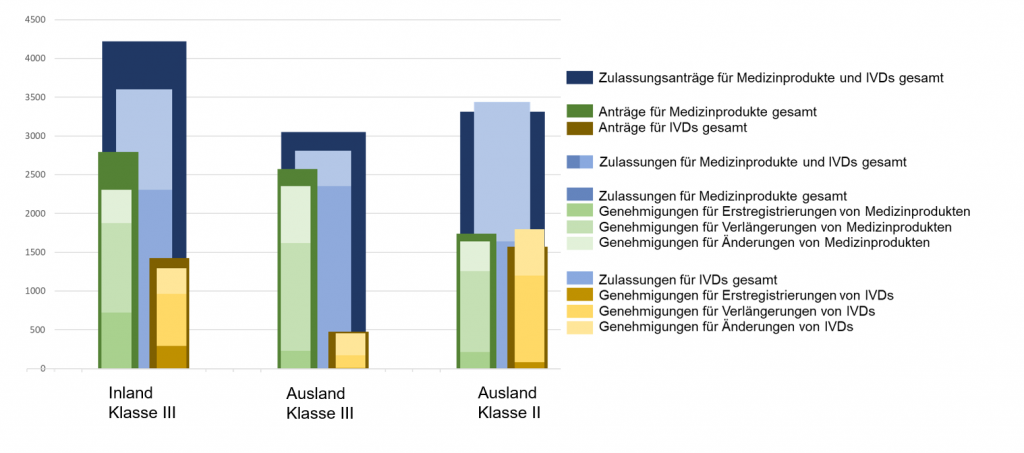
Grafik 2: Prozentuale Verteilung der drei Zulassungsarten bei der NMPA

Grafik 3: Prozentuale Aufteilung der Zulassungen von Medizinprodukten und IVDs bei der NMPA

Grafik 4: Anzahl der genehmigten Registrierungen von Januar 2015 bis Dezember 2020 bei der NMPA
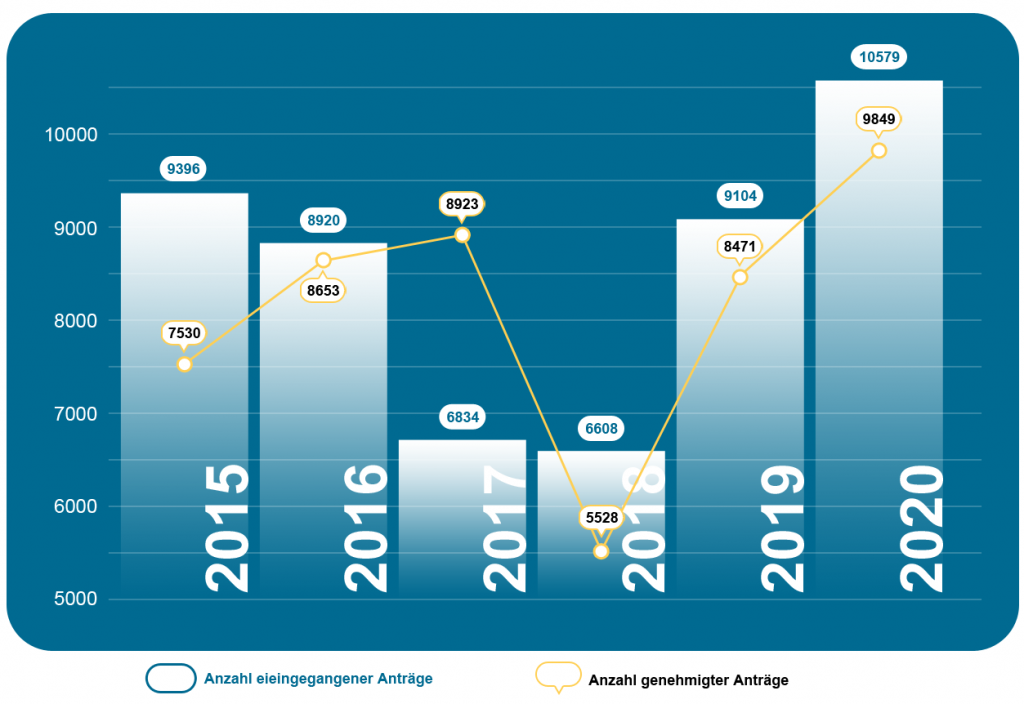
Grafik 5: Anzahl der genehmigten Neuregistrierungen von Januar 2020 bis Dezember 2020 bei der NMPA
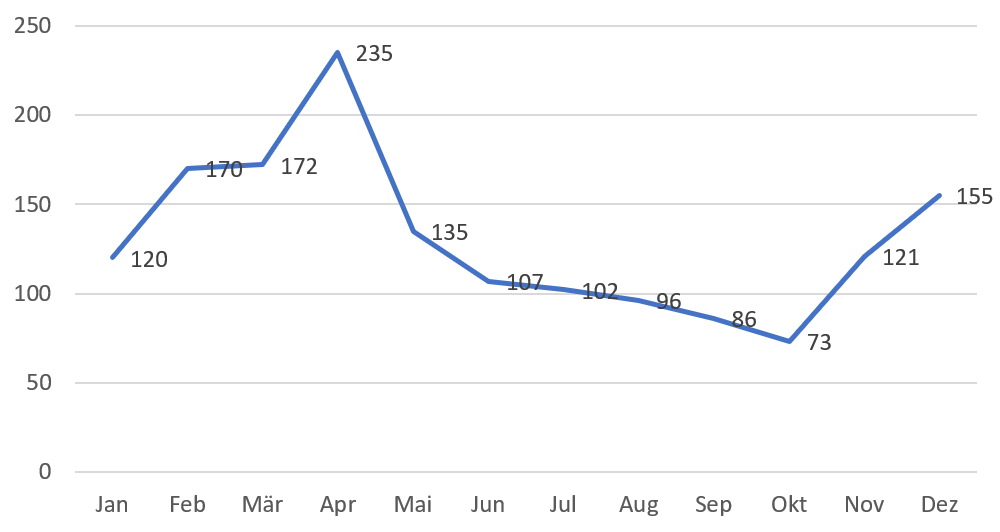
Im Jahr 2020 genehmigte die NMPA insgesamt 1.572 Neuregistrierungen.
Die Genehmigungsbehörden für Medizinprodukte in den Provinzen (MPAs) genehmigten insgesamt 29.650 Anträge für inländische Medizinprodukte der Klasse II in China, was einem Anstieg von 74,2% gegenüber 2019 entspricht.
Die Genehmigungsbehörden für Medizinprodukte in den Städten (MPAs) bearbeiteten insgesamt 34.644 Anträge auf die Zulassung von inländischen Medizinprodukten der Klasse I in China, was einem Rückgang von 106,8% gegenüber 2019 entspricht.
China konzentriert sich weiterhin auf den Import von hochwertigen und teuren medizinischen Geräten aus dem Ausland. Die fünf wichtigsten Produktgruppen der Klasse II und III ausländischer Herkunft, die 2020 registriert werden sollten, waren:
- Zahnärztliche Instrumente
- Medizinische Bildgebung
- Passive Implantate
- Chirurgische Instrumente für neurologische und kardiovaskuläre Eingriffe
- Geräte und Instrumente für die Ophtalmologie
Die USA, Deutschland, Japan, Korea und die Schweiz haben die höchste Anzahl von Erstzulassungen für Medizinprodukte in China, die 72,3% der gesamten Erstzulassungen für Medizinprodukte ausmachen.
Die Top 10 Länder – Export von Medizinprodukten im Jahr 2020 nach China
- USA
- Deutschland
- Japan
- Südkorea
- Schweiz
- Taiwan
- Frankreich
- Schweden
- Niederlande
- Israel
Fast-Track-Zulassung für Medizinprodukte
Die NMPA erhielt 197 Anträge auf Sonderprüfung und Zulassung innovativer Medizinprodukte und 22 Anträge auf vorrangige Prüfung. Insgesamt 26 inländische Medizinprodukte haben die Sondergenehmigung erhalten, um im Jahr 2020 als innovative Medizinprodukte auf den Markt zu kommen.
Von 2014 bis 2020 hat die NMPA insgesamt 95 inländische innovative Medizinprodukte (78 lokale Marken) und 4 ausländische innovative Medizinprodukte (4 globale Marken) zugelassen.
Weitere Informationen zu diesem Thema erhalten Sie bei
Cisema (Hong Kong) Limited
Tel.: +852 3462 2483
info@cisema.com
www.cisema.com

 English
English  Italiano
Italiano  Français
Français  日本語
日本語  한국어
한국어